Exercices de pharmacométrie
Pour déterminer la constante d’équilibre (KD) d’un ligand pouvant être directement radiomarqué, on utilise une méthode dite « par saturation ». Pour cela, on prépare 2 séries de plusieurs tubes :
- Série S1 : récepteur concentration constante + radioligand en concentration croissante
- Série S2 : récepteur concentration constante + radioligand en concentration croissante + large excès de ligand froid
Après incubation pour atteindre l’état d’équilibre, le contenu de chaque tube est filtré et la radioactivité retenue sur le filtre est mesurée à l’aide d’un détecteur à scintillation. On détermine ainsi la liaison totale et la liaison non spécifique, puis on déduit la liaison spécifique du radioligand. Connaissant la liaison spécifique L*R pour chaque concentration en L*, on obtient la courbe de saturation suivante :
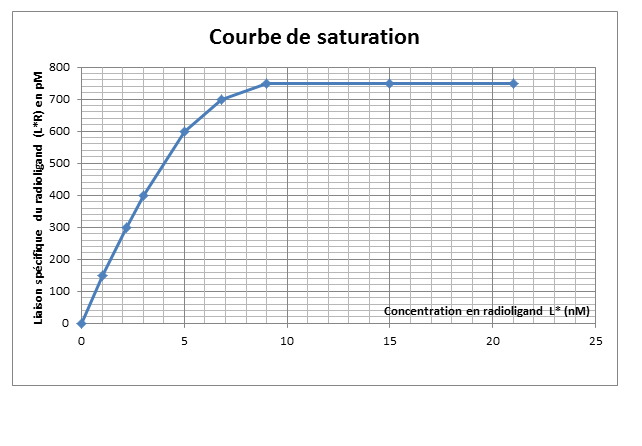
Question 1
Est-il nécessaire de vérifier que le ligand froid et le radioligand ont la même affinité pour le récepteur avant d’utiliser la méthode par saturation ? Répondre par oui/non.
Explication supplémentaire pour bien comprendre:
Il faut que le KD du radioligand déterminée par la courbe de saturation soit égale au KD du ligand froid, sinon la méthode ne présente aucun intérêt. En effet, on se fiche de connaitre le KD du radioligand s’il n’est pas égal au KD du ligand froid à étudier.
Question 2
Quelle est la série de tube permettant de déterminer la liaison totale ? La liaison non spécifique ? Justifier
Série 2 : liaison non spécifique
Justification : Les radioligands se fixent sur les sites récepteurs de haute affinité. En ajoutant un très large excès de ligand froid (série 2), il va y avoir un déplacement de l’équilibre : le ligand froid va déplacer le radioligand de son site récepteur de haute affinité non pas parce qu’il a une meilleure affinité (cf réponse précédente) mais simplement parce qu’il est présent en quantité beaucoup plus grande. Le radioligand privé de son site récepteur de haute affinité va alors se fixer sur des sites de faibles affinités. Cette fixation sur des sites de faible affinité, dite liaison non spécifique, n’est pas saturable. Cela signifie que quel que soit l’excès de ligand froid ajouté, il restera toujours de la place pour que les radioligands puissent se fixer sur des sites de faible affinité (les ligands froids en excès se fixent aussi sur des sites de faible affinité exactement comme les radioligands). On détermine ainsi la liaison non spécifique. On considère en effet qu’un excès suffisant en ligand froid supprime complètement la liaison spécifique du radioligand sur les sites récepteurs de haute affinité. La série 1 détermine la liaison totale (liaison spécifique + liaison non spécifique) puisque en absence de ligand froid, le radioligand va se fixer sur son site récepteur de haute affinité (liaison spécifique) mais aussi un peu sur les sites de faibles affinités (liaison non spécifique)
Question 3
Un détecteur à scintillation est composé d’un scintillateur et d’un photomultiplicateur. Rappeler brièvement la fonction de ces deux éléments.
Photomultiplicateur : composé d’une cellule photoélectrique qui transformant les photons émis par le scintillateur en électrons. Le courant obtenu est alors amplifié et l’intensité du courant collecté est finalement proportionnelle à l’énergie perdue par le rayonnement. Cela permet de dénombrer les rayonnements et d’en mesurer l’énergie.
Question 4
Déterminer graphiquement le KD du ligand
Question 5
Donner le nom de l’autre représentation graphique utilisée dans la méthode de saturation pour déterminer avec plus de précision le KD du ligand. Expliciter sur un schéma les points remarquables de cette représentation graphique. (on ne demande pas de tracer la courbe avec les vraies valeurs mais juste un schéma à mains levé)

Pour déterminer l’affinité d’un ligand L pour son site récepteur R par la méthode de saturation, on le marque avec du tritium. On effectue 5 expériences successives de binding avec des concentrations croissantes en radioligand L*. On utilise un filtre DEA-nitrocellulose pour piéger sélectivement les complexes L*R formés. La radioactivité présente au niveau du filtre et au niveau du filtrat est mesurée. On obtient le tableau suivant :
| B en mol/L | 2,25.10-5 | 2,5.10-5 | 2,75.10-5 | 3.10-5 | 3,25.10-5 |
|---|---|---|---|---|---|
| F en mol/L | 6,43.10-6 | 8,33.10-6 | 1,10.10-5 | 1,5.10-5 | 2,17.10-5 |
| B/F | 3,5 | 3 | 2,5 | 2 | 1,5 |
Nb1 : la concentration en protéine est constante dans chaque expérience : [PT]=2,00.10-5 M
Nb2 : B (« bound ») correspond à L*R et F (« free ») correspond à L*
Question 1
La méthode par saturation utilisée ici peut-elle s’appliquer à tous les ligands ? Si non, donner brièvement le principe d’une autre méthode utilisable pour déterminer l’affinité d’un ligand.
- le ligand peut être radiomarqué avec I125 ou H3
- ligand et radioligand ont même affinité pour leur récepteur commun
La méthode par compétition(= méthode par déplacement) est utilisée si une des deux conditions ci-dessus n’est pas respectée.
Principe méthode de compétition:On prend le ligand à étudier et on quantifie sa capacité à déplacer un radioligand dont les propriétés ont été déterminés préalablement par méthode de saturation. En pratique, on utilise une concentration fixe de recepteur et de radioligand, puis on ajoute une concentration croissante de ligand à étudier. On détermine la concentration de ligand à étudier inhibant 50% de la liaison du radioligand (CI50). L’équation de Cheng et Prussof relie la CI50 et le Ki (dans la méthode par compétition, la constante d’affinité KD s’appelle Ki, mais en fait KD = Ki)
Question 2
Expliciter sur un schéma les points remarquables d’une courbe de saturation. (on ne demande pas de tracer la courbe avec les vraies valeurs mais juste un schéma à main levée)

Question 3
Même consigne que ci-dessus avec la droite de Scatchard.

Question 4
Etablir l'équation littérale de la droite de Scatchard
La représentation de Scatchard est une droite du type y = a.x + b avec :
- y = L*R/L*
- x = L*R
- b = Bmax/KD
- a = -1/KD
Question 5
A partir des résultats de l’énoncé, calculer le nombre de sites récepteurs n pour le ligand, Bmax et KD (le tracé de la droite de Scatchard avec les vraies valeurs n’est pas demandé)
-
Méthode par régression (plus rapide):
A la calculatrice, à partir des valeurs du tableau, on obtient la droite de régression B/F = (-2.105).B + 8
Or, nous savons que l'équation de la droite de Scatchard est la suivante:
B/F = (-1/KD).B + Bmax/KD
Par analogie numérique, on peut déduire que:
KD = 5.10-6 M
Bmax/KD=8
Bmax = 4.10-5 avec [PT] = 2.10-5 M et n.[PT] = Bmax
n = 2 -
Méthode graphique(ne jamais faire sauf si explicitement demandé):
B en mol/L 2,25.10-5 2,5.10-5 2,75.10-5 3.10-5 3,25.10-5 B/F 3,5 3,0 2,5 2,0 1,5
A partir des données du tableau, on peut tracer la droite de Scatchard et déterminer graphiquement les valeurs trouvées par régression:

